Memahami Good Laboratory Practice (GLP) dan Perbedaannya dengan ISO 17025

GLP dan ISO 17025 adalah standar mutu laboratorium pedoman internasional yang mengatur sistem mutu laboratorium, mencakup seluruh siklus kegiatan pengujian mulai dari perencanaan, pelaksanaan, pencatatan, pelaporan, hingga pengarsipan. Tujuannya agar laboratorium dapat bekerja sesuai praktik terbaik yang dapat dipertanggungjawabkan secara hukum.
Sejarah GLP
GLP berawal pada 1970-an saat Food and Drug Administration (FDA) menemukan berbagai pelanggaran di laboratorium toksikologi Amerika Serikat. Penyelidikan terhadap ±40 laboratorium mengungkap masalah seperti:
- Personel tidak kompeten
- Protokol dirancang atau diterapkan dengan buruk
- Prosedur tidak sesuai ketentuan
- Data mentah tidak tertelusur
- Metode tidak valid
- Peralatan tidak dikalibrasi
- Arsip dan pengambilan sampel tidak memadai
Untuk menghindari praktik laboratorium yang keliru, FDA memberlakukan aturan baru yang mencakup studi keselamatan klinis dan nonklinis, serta mewajibkan setiap laboratorium menerapkan prinsip-prinsip kerja laboratorium yang baik. Draft GLP diterbitkan di tahun 1976 dan mulai dikembangkan ke seluruh dunia pada tahun 1979. Sehingga pada saat itu masing-masing negara mulai menyadari pentingnya standar ini dan mulai diterapkan di berbagai laboratorium.
Timeline penting GLP:
- 1972 – Istilah GLP muncul di New Zealand Testing Laboratory Registration Act.
- 1973 – Pemerintah Denmark mengadopsi GLP.
- 1976 – FDA mengusulkan peraturan GLP.
- 1977 – ILAC (International Laboratory Accreditation Cooperation) dibentuk.
- 1978 – FDA meresmikan Good Laboratory Practice Regulations dalam bentuk Final Rule.
- 1978 – ILAC Task Force C mengembangkan persyaratan teknis yang menjadi cikal bakal ISO 17025.
Pengertian GLP
GLP adalah sistem mutu terkait proses organisasi dan kondisi yang menjamin kesehatan, keamanan, serta keselamatan dalam pengujian. Awalnya fokus pada laboratorium toksikologi, namun kini berlaku luas untuk memastikan laboratorium menerapkan tata cara yang menghasilkan data sah secara ilmiah maupun hukum.
Tujuan GLP :
- Merencanakan dan mendokumentasikan pengujian secara tepat dan lengkap
- Membatasi pemborosan sumber daya
- Menjamin kualitas dan keterbandingan data
- Mendukung saling pengakuan hasil antar-laboratorium
GLP berperan membantu peneliti mendapatkan hasil yang konsisten, dapat diuji ulang, diaudit, serta diakui di tingkat internasional. Prinsipnya bukan menilai kaidah ilmiah studi, tetapi menjamin validitas hasil uji, terlepas dari metode analisis yang digunakan.
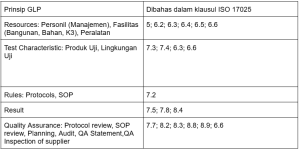
5 Prinsip Dasar GLP
- Sumber Daya – Mengatur ketersediaan personel, fasilitas, dokumentasi sistem mutu, serta K3.
- Characterisation – Proses menentukan sifat-sifat sampel dan kondisi lingkungan saat pengujian.
- Rules – Mencakup protocols/study plans (rencana uji) dan SOP (petunjuk rinci proses).
- Result – Pedoman pengumpulan data mentah, penyusunan laporan, dan arsip.
- Quality Assurance – Audit, inspeksi, serta pengendalian mutu melalui kualifikasi SDM, pelatihan, perawatan dan kalibrasi peralatan, serta validasi metode.
Baca juga Jaminan Mutu Hasil Uji Lab dan perbedaan QA dan QC di Laboratorium
Perbedaan GLP dan ISO 17025
Serupa tapi tak sama, Prinsip-prinsip GLP seringkali dinilai sama atau mengadopsi ISO 17025, namun apakah perbedaannya?
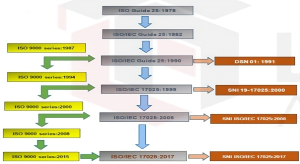
Berdasarkan sejarah munculnya, GLP dijadikan landasan utama dalam laboratorium yang sejalan dengan sistem jaminan mutu seperti ISO 9001/ISO 22000 dan ISO 17025.
Selain itu, GLP diterbitkan oleh FDA tahun 1972 sedangkan ISO 17025 diterbitkan oleh ILAC tahun 1978.
Dalam perjalanannya dokumen sistem manajemen mutu ISO 17025 ini mengalami perubahan dari ISO guide 25 tahun 1978 termasuk persyaratan manajemen untuk ISO 9000 series. Di Indonesia sendiri sistem manajemen mutu sudah diadopsi sejak tahun 1991 dimulai dari DSN-01 hingga saat ini berlaku SNI ISO 17025 : 2017 yang merupakan adopsi utuh ISO 17025 : 2017
GLP
memastikan data yang dihasilkan valid dan dapat dipertanggungjawabkan secara ilmiah dan hukum selain itu ISO 17025 menetapkan standar kompetensi untuk lab uji dan kalibrasi yang mana keduanya saling beririsan.
ISO 17025
ISO 17025 adalah standar kompetensi umum bagi laboratorium pengujian dan kalibrasi. Standar ini memastikan laboratorium memiliki sistem mutu yang berjalan, kompetensi teknis yang memadai, serta mampu menghasilkan data yang sahih. Persyaratannya mencakup manajemen (diadopsi dari ISO 9001) untuk efektivitas mutu dan teknis untuk validitas hasil.
GLP vs ISO 17025
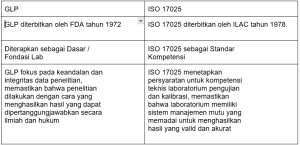
Meskipun secara fokus ada sedikit perbedaan akan tetapi secara prinsip hampir tidak ada perbedaan antara GLP dan sistem manajemen ISO 17025 karena keduanya memiliki tujuan yang sama dalam menjamin hasil pengujian yang dapat dipertanggung jawabkan secara hukum. Beberapa prinsip GLP juga banyak diadopsi dari beberapa klausul ISO 17025 diantaranya
Kesimpulan
Good Laboratory Practice (GLP) adalah sistem mutu yang memastikan data laboratorium valid, tertelusur, dan dapat dipertanggungjawabkan secara ilmiah maupun hukum, diterapkan sejak 1970-an oleh FDA di berbagai bidang non-klinis. ISO/IEC 17025 adalah standar internasional yang menekankan kompetensi teknis laboratorium pengujian dan kalibrasi.
Namun meski berbeda fokus, GLP menitikberatkan pada integritas data, sedangkan ISO 17025 pada kompetensi teknis; keduanya saling melengkapi untuk membentuk laboratorium yang kredibel dan berstandar internasional, serta memiliki keterkaitan dengan sistem manajemen mutu lain seperti ISO 9000 series.
Ingin memahami GLP lebih dalam dan siap menerapkannya di laboratorium? Hubungi melalui bit.ly/tanyalichemindo

Baca juga Alat Laboratorium dan alat lainnya




